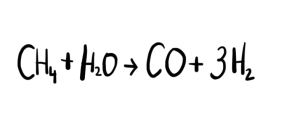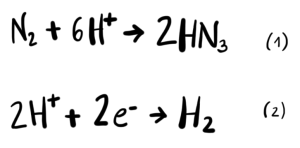Hoy, con esta entrada, empiezan una serie de artículos, que iré sacando poco a poco, sobre las bioenergías. Sin ninguna duda, la producción de energía de forma totalmente limpia es una de las aplicaciones más importantes de la biotecnología, y es fundamental que todo el mundo conozca el potencial que se esconde tras esta rama de la investigación para poder cambiar, tan pronto como sea posible, el uso actual de los recursos de nuestro planeta.
El hidrógeno será posiblemente el combustible del futuro. Por muchos motivos representa una alternativa muy conveniente para reemplazar a los combustibles convencionales: es renovable, limpio y produce durante su combustión únicamente vapor de agua y energía. Además posee el mayor contenido energético por unidad de peso, 122‐142 kJ/g, comparado con cualquier combustible conocido.
¿Cómo se produce el biohidrógeno?
Existen varias alternativas para producir hidrógeno: la electrólisis de agua, la reformación termocatalítica de combustibles fósiles y la combustión de biomasa. Actualmente el 96% del hidrógeno producido se obtiene a partir del reformado del gas natural (metano) con vapor de agua, pero esto implica el gasto de una fuente de energía no renovable para su obtención y la emisión de gases dañinos al medio ambiente.
Así pues, se hace evidente la necesidad actual por producir hidrógeno de origen biológico. Hay muchos equipos de investigación trabajando en el tema, pero las siguientes aproximaciones son las más estudiadas y prometedoras a día de hoy.
-
Biofotólisis del agua empleando algas y cianobacterias
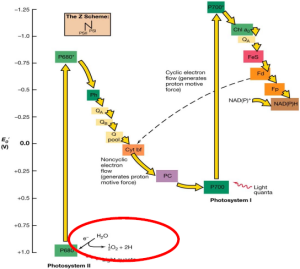
La fotosíntesis es un mecanismo por el cual un organismo (fotosintético) absorbe energía lumínica y la transforma en energía química. La energía química se almacena en enlaces químicos, formando las moléculas orgánicas, principalmente azúcares. Las plantas verdes fotosintetizan sus carbohidratos utilizando poder reductor (los electrones) del agua, y recolectando la luz solar mediante pigmentos. Al oxidar el agua producen O2 (que se libera a la atmósfera) y obtienen los electrones, que entran en un proceso denominado “cadena transportadora de electrones”.
La finalidad de esta cadena es pasar electrones de alta energía a lo largo de varias proteínas de membrana y los complejos de fotosistemas I y II. Cada proteína utiliza parte de la energía de los electrones para generar un gradiente de protones a través de dicha membrana. Los protones, en mayor concentración a un lado de la membrana, tenderán a moverse hacia el otro lado siguiendo su gradiente de concentración. La energía de este movimiento se almacena en forma de ATP mediante una ATPasa de membrana. Los electrones, al finalizar la cadena, se unen desde la proteína de membrana ferredoxina a una molécula de NADP+ que se transforma en NADPH.
La biofotólisis consiste en la descomposición del agua en hidrógeno y oxígeno gracias a la luz solar y la capacidad fotosintética de algas y cianobacterias. En este proceso entran en juego dos tipos de enzimas que producen hidrógeno: las hidrogenasas y las nitrogenasas.
Las hidrogenasas producen H2 utilizando esos electrones al final de la cadena, uniéndolos a un protón, en lugar de a NADP+. Catalizan la reacción siguiente, donde X representa a una molécula portadora de electrones (normalmente la ferredoxina (Fd)), que se reduce con el agua como donador de electrones por la reacción fotoquímica de la biofotólisis.
Por su parte las nitrogenasas catalizan la reacción de fijación de nitrógeno atmosférico, y en una reacción secundaria, cataliza la reducción de protones.
¿Y qué microorganismos hacen esto? Las cianobacterias filamentosas utilizan la enzima nitrogenasa para realizar la biofotólisis directa, mientras que, las microalgas unicelulares utilizan la enzima hidrogenasa reversible para realizar el mismo bioproceso.
-
Fotofermentación de compuestos orgánicos por bacterias fotosintéticas
Algunos organismos procariotas son capaces de realizar un proceso muy importante a nivel ecológico, la fijación de nitrógeno. El nitrógeno es un componente fundamental de todos los seres vivos y se encuentra en la atmósfera en forma gaseosa. Para que el N2 se incorpore a los compuestos y moléculas de un organismo, primero debe tomar una forma orgánica.
La fotofermentación tiene lugar bajo condiciones anaeróbicas, y es realizada por un grupo de bacterias fotosintéticas (bacterias púrpura) que realizan una fotosíntesis anoxigénica. Se llaman “púrpuras” porque son fototróficas y captan la energía de la luz mediante bacterioclorofilas y carotenos que le dan ese color. Estas bacterias fototróficas no captan CO2 del aire como las plantas verdes, sino que utilizan una gran diversidad de compuestos orgánicos como fuente de carbono, por ejemplo ácidos grasos, azúcares y aminoácidos.
-
Fermentación oscura de compuestos orgánicos ricos en carbohidratos por bacterias anaerobias
A diferencia de la fotofermentación, la fermentación oscura se lleva a cabo de forma independiente a la luz y los microorganismos necesitan como fuente de carbono glucosa, xilosa, almidón, celulosa u otras fuentes que pueden ser generadas a partir de la hidrólisis de polisacáridos, proteínas y lípidos.
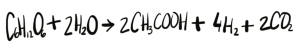
Reacción producida durante la fermentación oscura, conocida como vía del acetato, y en la que se producen e moles de hidrógeno por mol de glucosa consumida.
A pesar de no habérsele prestado tanta atención como a la producción de hidrógeno por microorganismos fotosintéticos, la producción de hidrógeno a partir de la fermentación oscura presenta claras ventajas para llevarla a escala industrial: las bacterias fermentativas presentan una alta tasa de producción de hidrógeno, pueden producir hidrógeno de forma constante, noche y día, a partir de materia orgánica, pueden alcanzar tasas de crecimiento suficientes como para mantener el sistema, y además se producen metabolitos con interés comercial (ácidos orgánicos).
La fermentación oscura es la técnica que ha demostrado poseer un mayor potencial, ya que, además de alcanzarse una producción de H2 mayor, resulta la más fácil de realizar técnicamente, los requerimientos energéticos son menores, la economía del proceso resulta más favorable y, por tanto, más factible comercialmente. Sin embargo, también se ha demostrado que un sistema de producción de H2 en tres etapas (los tres sistemas anteriores acoplados) incrementa el rendimiento de cada sistema por separado.
Fuentes:
Martínez y García. Fermentación oscura, fotofermentación y biofotólisis: análisis de su aplicación en secuencia para la producción de hidrógeno biológico.